| 池州市天方富硒生物科技 | 河北天天乳业集团有限公 | 济源市鑫源饮品有限公司 | 北京顶养科技发展有限责 |
| 河南永铂利商贸有限公司 | 焦作优贝饮品有限公司 | 昆明品世食品有限公司 | 青岛慧能多农业发展有限 |
| 孟州市景一饮品有限公司 | 广东同润堂饮料有限公司 | 西安冰峰饮料股份有限公 | 蚌埠市福淋乳业有限公司 |
乔慧1 , 卢 柯 1 ,杨世玲 1 ,薛楚然 1 ,刘树文 1,2*( 1. 西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2. 陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌 712100)
摘要:葡萄酒中的乳酸菌, 尤其是一些酒酒球菌可产糖苷酶, 在苹果酸乳酸发酵 (Malolactic Fermentation,MLF)过程中作用于香气前体,释放出挥发性的香气物质,从而增加葡萄酒的香气复杂性。本试验以中国5 个酿酒产区 19 株酿酒特性优良的酒酒球菌和一株商业菌株为试验材料,通过测定五种糖苷酶活性,对其中 5 株糖苷酶活性高的菌株研究其在葡萄酒环境中糖苷酶的酶学性质。 结果表明 20 株菌在相应底物作用下均含有可检测的糖苷酶活性,不同菌株酶活性差异显着,地区间差异不显着。最适 pH 为 4.0,最适温度为45℃,乙醇、葡萄糖和果糖在低浓度时有促进作用,高浓度时抑制作用显着,但各种酶活性表现为菌株依赖性。在模拟酒条件下,菌株相对酶活仅是菌株酶活性的 9.805%-32.331%.总之,在所选菌株中,SD-1f在葡萄酒环境中的糖苷酶活性。
关键词:葡萄酒;酒酒球菌;糖苷酶活性
在葡萄酒酿酒体系中, 两类微生物发挥重要作用, 即酵母菌和乳酸菌, 分别进行酒精发酵 (AlcoholFermentation, AF)和苹果酸乳酸发酵(Malolactic Fermentation, MLF) .酿酒酵母可产多种酶,但糖苷酶并不是主要的酶,且在 AF 过程中,糖苷酶活性受葡萄糖的显着抑制 [1] .而一些非酿酒酵母具有大量的 β-葡萄糖苷酶活力,但仅局限于 AF 开始阶段,随接种酿酒酵母的生长,非酿酒酵母的数量急剧下降 [2] .因此,酵母菌对糖苷类香气的释放作用有限。
乳酸菌对葡萄酒中香气的形成具有重要影响,在MLF过程中可增加香气的复杂性,因为酒酒球菌能够较好地适应葡萄酒中的低pH和高酒精度等环境,在多数MLF过程中起主导作用 [3] .研究表明,酒酒球菌可产糖苷酶,通过水解葡萄糖苷(香气前体)释放香气物质,增加并改良葡萄汁和葡萄酒的花香和果香,并产生浓郁、自然的葡萄酒香气 [4] .Guilloux-Benatier et al.(1993)首次报道了关于酒酒球菌β-D-葡萄糖苷酶的研究 [5] ,目前已经有大量相关研究 [6-11] .Grimaldi 等在2000年首次提出多酶的存在,为了证实这一猜想,他们利用其它底物对22株商业菌株的专一酶活性进行测定,证实酒酒球菌中存在葡萄糖苷酶、 木糖苷酶、 阿拉伯糖苷酶和低含量的鼠李糖苷酶, 尽管糖苷酶的种类是菌株依赖性的 [12] .
葡萄浆果中存在着游离态和结合态两类香气物质,游离态香气物质可以直接从葡萄酒中挥发出来,使人产生嗅觉反应;结合态香气物质没有香气,必须经过分解释放出游离态呈香物质才能产生香气 [13] .通常,后者含量比前者要丰富得多。结合态香气物质由糖基和糖苷配基组成,糖基通常是 β-D-葡萄糖、α-D-葡萄糖、β-D-木糖、β-芹菜糖、α-L-阿拉伯糖和 α-L-鼠李糖 [14] ;糖苷配基包括单萜烯、C13-降异戊二烯、苯衍生物和脂肪族化合物,是对葡萄酒香气有贡献的物质 [14-16] .其中萜烯类化合物是一些葡萄酒香气中最重要的组成部分, 例如在麝香葡萄、 琼瑶浆、 雷司令和玛尔维萨葡萄酒中 [12, 17] .
葡萄酒中结合态香气前体可通过酸解、热水解或酶解释放出挥发性的糖苷配基 [12, 15] ,其中酶解是一种更接近于自然、温和的方法,极具商业化应用前景,一般采用酶解的方法来增强葡萄酒香气 [4, 18] .糖苷酶对葡萄糖苷的水解,可一步反应,也可两步反应(顺序水解)。在顺序水解模式中,首先一种外切糖苷酶(α-L-鼠李糖苷酶、α-L-阿拉伯糖苷酶、β-D-芹菜糖苷酶或 β-D-木糖苷酶)切断糖内连接,释放出相应的糖和一个 β-D-葡萄糖苷,随后 β-D-葡萄糖苷酶催化 β-D-葡萄糖苷的水解,释放出相应的糖苷配基和葡萄糖;在一步反应模式中,双葡萄糖苷酶催化糖苷配基与二糖苷之间的连接,从而释放出相应的糖苷配基和二糖 [19] .α-D-葡萄糖苷酶可降解酵母菌衍生的大分子物质,为乳酸菌生长提供营养物质 [5, 16] .
综上所述, 葡萄酒中的酒酒球菌可通过糖苷酶水解葡萄糖苷释放香气物质, 影响葡萄酒香气质量。尽管许多学者已经证明乳酸菌能够促进香气化合物释放, 但关于参与反应的酶的种类的知识却相对较少 [20] ,且仅有少量菌株对多种底物有持续稳定的高活性。因此,研究各种酿酒参数和葡萄酒环境对糖苷酶活性的影响,可在菌株筛选时预测菌株在酿酒中发挥的作用以及它对葡萄酒香气特性的影响,减少乳酸菌对葡萄酒产生负面影响,为生产优质葡萄酒奠定基础。
1 材料与方法
1.1 供试菌株
菌株来源于西北农林科技大学葡萄酒学院保存的中国 5 个酿酒产区的优良酒酒球菌,包括山东 7株(SD-1a,SD-2a,SD-1b,SD-1g,SD-1f,SD-2gh,SD-2h) 、新疆 3 株(XJ-2a,XJ-2b,XJ-3a) 、陕西 2 株(SX-1b,SX-1a) 、河北 4 株(HB-1a,HB-1b,HB-1c,HB-2b) 、宁夏 3 株(NX-1e,NX-4b,NX-3g) ,和一株商业菌株(31 DH) .
1.2 试剂
ATB 培养基:蛋白胨 10g,酵母浸粉 5g,葡萄糖 10g,MgSO 4 ?7H 2 O 0.2g,MnSO 4 ?4H 2 O 0.05g,盐酸半胱氨酸 0.5g,番茄汁 25%(v/v) ,蒸馏水定容至 1000mL,pH 调至 4.8,121℃灭菌 20min.pNP-βGlu、pNP-aGlu、pNP-βXyl、pNP-aRha、pNP-aAra 1 购买自 Sigma 公司,其它试剂均为分析纯。
1.3 仪器与设备
UV-2450 紫外分光光度计,Eppendorf Centrifuge 5417R 型冷冻离心机,10mm 狭缝比色皿,MJ-250B 恒温培养箱,AIR TECH 超净工作台,HH-4 数显恒温水浴锅。
1.4 试验方法
1.4.1 菌株活化
酒酒球菌在 ATB 培养基 26℃2 次连续活化培养,随后接种于 ATB 液体培养基上扩大培养。通过测定 600nm 下的吸光值了解细菌的生长情况,当 OD 600 接近 1 时,将培养液放置于 4℃冰箱中过夜。
1.4.2 酒酒球菌糖苷酶活性测定
试验改进了 Grimaldi 等(2005)所用的酒酒球菌糖苷酶活性测定方法 [13, 17] ,反应总体积为 80μL,其中每个反应包括 McIlvane 缓冲液 40μL,菌悬液 20μL,底物溶液 20μL.
菌悬液制备:从 ATB 扩大培养基中吸取 3mL 培养液,离心 5min(10000rpm,4℃)收集菌体,用 0.85% NaCl 溶液重悬,重复 2 次操作,使菌体密度 OD 600 ≈0.5,并测定菌密度 OD 600 .McIlvane 缓冲液制备:由 0.1mol/L 柠檬酸和 0.2mol/L 磷酸氢二钾配制而成,缓冲液浓度为0.2mol/L,PH 为 4.0.
底物溶液制备:分别配制对硝基苯基 β-D-葡萄糖苷(pNP-βGlu) 10mmol/L,对硝基苯基 α-D-葡萄糖苷(pNP-aGlu)10mmol/L,对硝基苯基 β-D-木糖苷(pNP-βXyl)7.5mmol/L,对硝基苯基 α-L-鼠李糖苷(pNP-aRha)7.5mmo/L,对硝基苯基 α-L-阿拉伯糖苷(pNP-aAra)7.5mmol/L.
反应体系混合均匀,于 37℃下反应 1h,随后立即加入 160μL 的 Na 2 CO 3 (0.5mmol/L)终止反应并显色,放置至室温,2500r/min 离心 18min ,吸取 200μL 上清液至另一离心管中。在 400nm 下用UV-2450 紫外分光光度计测定上清液的吸光值(OD) ,重复 3 次。空白为 McIlvane 缓冲液替代菌悬液的反应体系,其他处理相同。
酶活定义: 以各种糖苷酶对应的糖苷为底物, 1min 每 1g/L 菌体细胞水解相应底物生成 1μmol/L 对硝基苯酚(pNP)的酶活力定义为一个酶活力单位 U.
1.4.3 糖苷酶酶学性质研究
1.4.3.1 pH 值对糖苷酶活性的影响
用 1mol/L HCL 或 NaOH 调节 McIlvane 缓冲液,设定 pH 值梯度为 2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0,在上述反应条件下测定酶活。
1.4.3.2 温度对糖苷酶活性的影响
通过恒温水浴锅设定温度梯度,分别设为 15、25、35、45、55℃,在上述反应条件下测定酶活。
1.4.3.3 乙醇、葡萄糖和果糖对糖苷酶活性的影响
分别设定乙醇浓度(4、8、12、14%(v/v) ) 、葡萄糖浓度(0.1、0.4、0.75、2%(w/w) )和果糖浓度(0.1、0.4、0.75、2%(w/w) ) ,在上述反应条件下测定酶活,对照为未加酒精、葡萄糖和果糖所测的酶活,即菌株糖苷酶活性测定中所测得的酶活,设定其相对酶活为 .
1.4.3.4 模拟酒对糖苷酶活性的影响
模拟酒配方为 [16] :酒精 11%(v/v) 、葡萄糖 2g/L、果糖 2g/L、pH 3.5, 20℃反应 1h 后测定酶活,对照为菌株糖苷酶活性测定中所测得的酶活,设定其相对酶活为 .
2 结果与分析
1 pNP-βGlu、pNP-aGlu、pNP-βXyl、pNP-aRha、pNP-aAra 为底物缩写形式,分别表示对硝基苯酚-β-D-葡萄糖苷,对硝基苯酚-α-D-葡萄糖苷,对硝基苯酚-β-D-木糖苷,对硝基苯酚-α-L-鼠李糖苷和对硝基苯酚-α-L-阿拉伯糖苷。
2.1 酒酒球菌的糖苷酶活性
以各糖苷酶相应的糖苷为特异性底物,在 37℃下反应 1h,活性测定结果见表 1,酶活力单位为μmol/(g·min)。
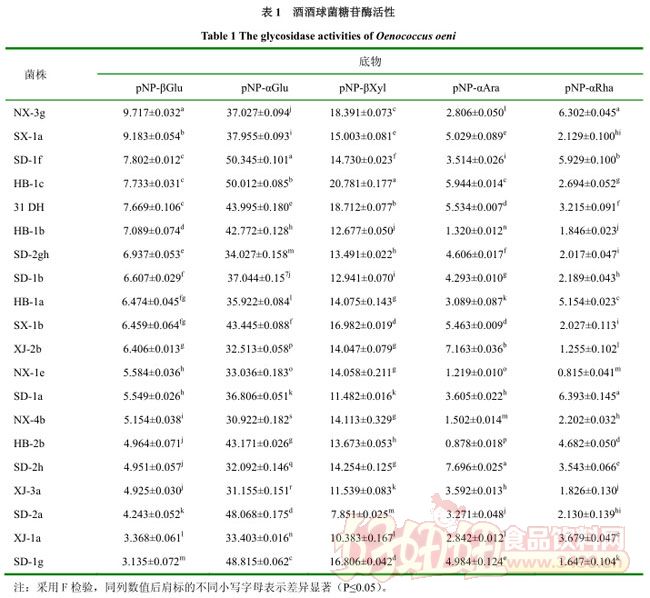
由表1可知,20株酒酒球菌在五类糖苷酶相应糖苷底物作用下, 都有可检测的糖苷酶活性 (0.815~50.345 μmol/(g·min)) .β-D-葡萄糖苷酶的平均酶活为 6.197μmol/(g·min),菌株间差异显着,酶活(NX-3g)是酶活的 3 倍,其中商业菌株 31 DH 的酶活力为 7.733 μmol/(g·min),在所测菌株中酶活相对较高。 对于 α-D-葡萄糖苷酶活性, 平均酶活为 39.126 μmol/(g·min), 是 β-D-葡萄糖苷酶的 6 倍,且酶活是 β-D-葡萄糖苷酶酶活的 5 倍,菌株间的差异显着。此外,这两种酶活性没有直接联系,例如 XJ-1a、XJ-3a 两种酶活性都很低,而一些菌株具有较高的 β-D-葡萄糖苷酶、较低的 α-D-葡萄糖苷酶活性(NX-3g,SX-1a) ,其他菌株也有相反的情况(SD-1g,SD-2a) .其他三种糖苷酶的测定也可以得出:β-D-木糖苷酶的平均活性是 β-D-葡萄糖苷酶活性的 2 倍,α-L-阿拉伯糖苷酶和 α-L-鼠李糖苷酶的活性都较小,但所有菌株都可以检测得到。由此可以推测,5 类糖苷酶活性的总体趋势为:α-D-葡萄糖苷酶>β-D-木糖苷酶>β-D-葡萄糖苷酶>α-L-阿拉伯糖苷酶≥α-L-鼠李糖苷酶。
同时通过对地区间的差异显着性分析, 可以得出对底物 pNP-βGlu、 pNP-αGlu、 pNP-βXyl、 pNP-αAra和 pNP-αRha 地区间显着性分别为 0.293、0.109、0.117、0.109 和 0.874,在 5%水平上差异不显着。因此地区不能作为区分菌株糖苷酶活性高低的依据。
众所周知酒酒球菌处于葡萄酒恶劣、复杂的环境中,如低 pH、低温、高乙醇浓度及葡萄糖和果糖等因素都可能对糖苷酶的活性产生影响, 因此有必要对菌株在单因素条件糖苷酶活性的变化进行研究。本试验中以 β-D-葡萄糖苷酶和 α-D-葡萄糖苷酶为依据,根据表 1 测定结果,选取酶活性高的 5株菌(NX-3g、SX-1a、SD-1f、HB-1c、31 DH) ,研究各因素对酶活性的影响。
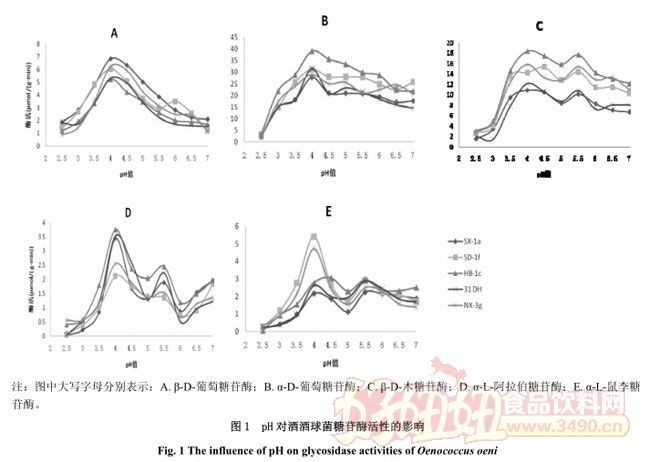
2.2 pH 对糖苷酶活性的影响
葡萄酒的 pH 是影响酒酒球菌生存与生长最重要的因素之一,同样的也会影响到糖苷酶的活性。由图 1 可知,从总体上来看,pH 值对 5 株酒酒球菌糖苷酶活性有显着影响。对 β-D-葡萄糖苷酶,菌株在 pH 4.0 时酶活性,酶活是酶活的 7 倍。对 α-D-葡萄糖苷酶,在 pH 2.5 时,酶活性几乎为零;随 pH 升高,抑制作用减弱,在 4.0 时达;大于 4.0 时,酶活性缓慢下降。对其他三种酶可以看出:在 pH 4.0 和 5.5 有两个峰值,在 pH 小于 4 时,菌株糖苷酶活性受显着抑制。因为葡萄果实中含有大量的与鼠李糖连接的香气物质,鼠李糖苷酶在酿酒过程中发挥重要作用 [21] ,但从图中可以看出其对底物的水解作用较弱,酶活仅为 5.419μmol/(g·min)。这一参数而言,各酶活性是菌株依赖性的。葡萄酒的 pH 通常为 3.0-4.0,在此 pH 时糖苷酶活性受抑制,只有低含量的酶活性。
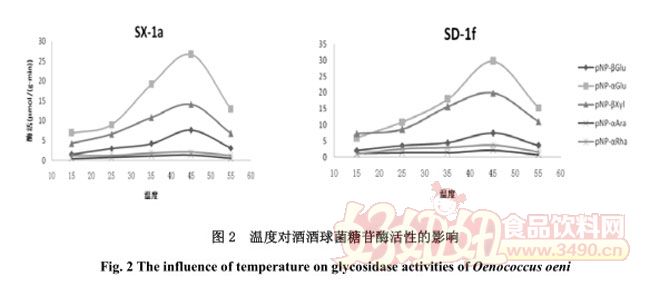
2.3 温度对糖苷酶活性的影响
考虑到酿酒过程中温度通常是在 10-30℃,因此测定了温度对糖苷酶活性的影响。虽然不同菌株的酶活性不同,但是随温度变化的总体趋势基本一致,所以选择 2 株菌(SX-1a、SD-1f)为代表,测定结果见图 2.由图中可以看出,五种酶的最适温度都在 45℃左右,在温度小于最适温度时,随温度升高酶活性相应增加,随着温度接近 55℃所有糖苷酶活性迅速下降。MLF 过程温度通常控制在20-23℃,在此温度下两株菌只有较低的酶活性。
2.4 乙醇、葡萄糖和果糖对糖苷酶活性的影响
乙醇和糖(包括葡萄糖、果糖)通常被认为对糖苷酶活性有抑制作用 [15, 22] .因此,本试验测定了这些物质对糖苷酶的影响,测定结果见图 3.
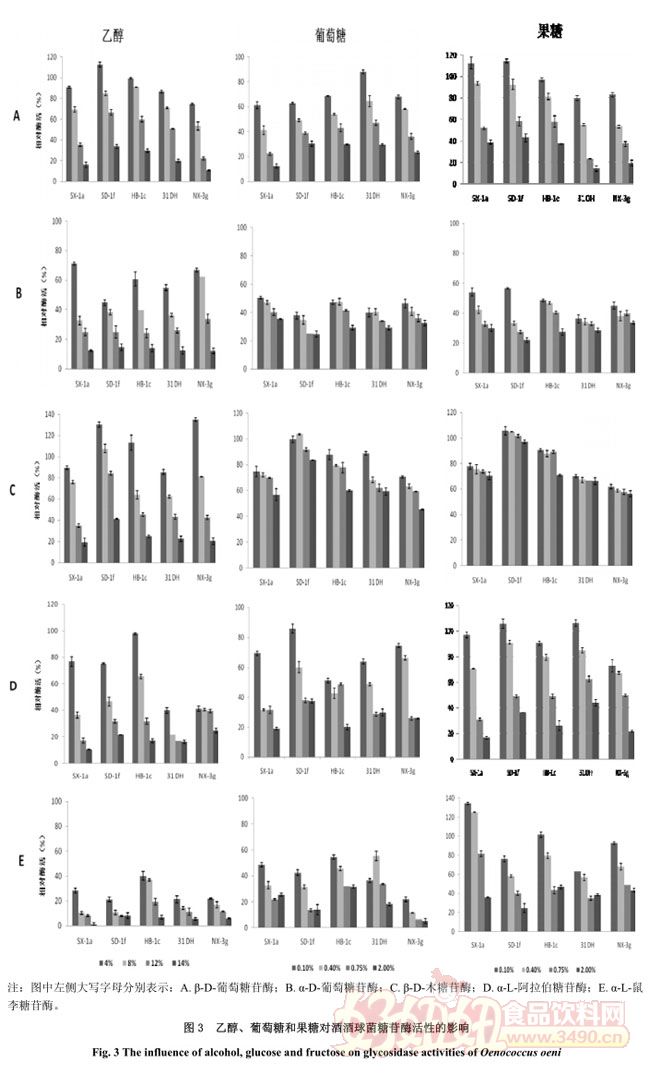
葡萄酒中乙醇浓度通常小于 15%(v/v), 大量的研究已经证明乙醇对糖苷酶活性的影响取决于菌株和乙醇浓度 [7, 22] . 目前有两种乙醇对糖苷酶活性影响的机制, 一种认为乙醇作为一种关键糖基中间物,当它的浓度增加时, 可以增加此酶的糖基转移酶的反应速率, 另一种解释认为乙醇可能改变膜通透性,促进细胞内酶和底物的接触 [22] ,酶活性下降可能由酶变性失活引起 [15] .由图 3 可知,在 4%乙醇浓度时, SD-1f 的 β-D-葡萄糖苷酶活性高于对照,其他菌株都低于对照,说明菌株对乙醇的耐受性是菌株依赖性的,随着乙醇浓度升高,酶活性迅速下降;所有菌株 α-D-葡萄糖苷酶在设定乙醇浓度下都受到抑制;低浓度(4%和 8%(v/v) )可促进 β-D-木糖苷酶活性;所有菌株 α-L-鼠李糖苷酶和 α-L-阿拉伯糖苷酶在测定浓度条件下也受到抑制,后者受抑制程度更显着,SX-1a 在 14%(v/v)抑制程度大于95%.这一参数而言,可以推断 SD-1f 在葡萄酒乙醇浓度 12%和 14%(v/v)下菌株酶活性保持。
大量研究已经证明葡萄糖和果糖会降低多种来源菌株的糖苷酶活性 [6, 23] .葡萄糖即使在测定浓度 0.1%(w/v)时,五种糖苷酶活性都受到不同程度的抑制,β-D-葡萄糖苷酶下降幅度为 12-40%,α-D-葡萄糖苷酶和 α-L-鼠李糖苷仅是对照的 50%.与本试验测定结果一致,Williams et al.(1993)证明葡萄酒中葡萄糖含量即使在残糖浓度仍对糖苷酶活性有抑制作用 [24] .随葡萄糖浓度增加,酶活性抑制作用增强,但不呈线性关系,其中 α-D-葡萄糖苷酶和 β-D-木糖苷酶下降不显着,其他三种酶活性受抑制显着。从总体来看,SD-1f 受影响最小,NX-3g 受影响。
与葡萄糖类似,果糖的典型反应也是抑制,尽管从总体来看降幅小于葡萄糖,但不同菌株受果糖的影响也不同。对菌株 31 DH 和 NX-3g,即使在浓度(0.1%(w/v) ) ,β-D-葡萄糖苷酶活性也受到抑制,而菌株 SX-1a 和 SD-1f 酶活性增强。在测定浓度下,所有菌株的 α-D-葡萄糖苷酶活性都受到显着抑制,仅是对照的 50%,但随浓度增加活性减小程度不显着。对 β-D-木糖苷酶,菌株 SD-1f 表现最为突出,基本上不受果糖的影响,其他菌株都受果糖的抑制,降幅小于 α-D-葡萄糖苷酶。α-L-阿拉伯糖苷酶和 α-L-鼠李糖苷酶在低浓度(0.10%和 0.40%(w/v) )时,一些菌株表现为促进,随果糖浓度升高至 2.00%时,酶活分别仅是对照的 44%和 46%.
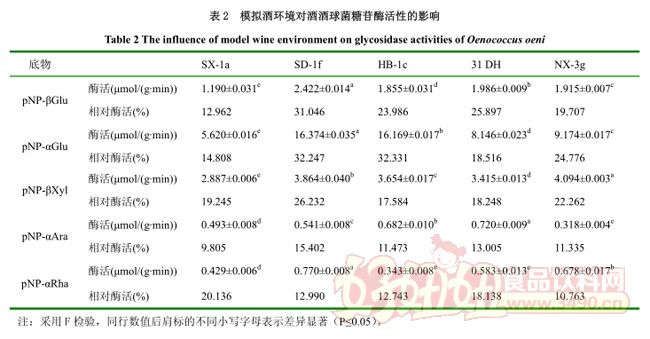
2.5 模拟酒对糖苷酶活性的影响
在大部分情况下,葡萄酒中酒酒球菌通常都处于上述各因素的综合作用下。为了研究这些参数的综合作用,测定了在模拟酒环境下菌株的糖苷酶活性,测定结果见表 2.从表中可以看出,菌株的相对酶活仅是菌株酶活性的 9.805%-32.331%,从总体来看,菌株 SD-1f 受模拟酒环境条件影响最小,与单因素测定结果一致,β-D-葡萄糖苷酶活性为 2.422μmol/(g·min),是对照的 31.046%.与本试验测定结果类似的,Grimaldi et al.报道多种酿酒参数(pH、乙醇、糖和温度)共同作用会增强对糖苷酶的抑制作用,同时不同菌株对参数的反应也不同 [7, 22] .
3 结论
本研究证明酒酒球菌不仅普遍产糖苷酶,而且糖苷酶种类不局限于 β-D-葡萄糖苷酶。20 株酒酒球菌在五类糖苷酶相应糖苷底物作用下, 都有可检测的糖苷酶活性, 且五类糖苷酶活性的总体趋势为:α-D-葡萄糖苷酶>β-D-木糖苷酶>β-D-葡萄糖苷酶>α-L-阿拉伯糖苷酶≥α-L-鼠李糖苷酶。α-D-葡萄糖苷酶活性,为乳酸菌生长提供营养物质,促进生长;β-D-葡萄糖苷酶是提升葡萄酒香气的关键酶,在筛选菌株时应优先考虑;α-L-鼠李糖苷酶和 α-L-阿拉伯糖苷酶活性很低,而葡萄果实中却含有较多的与鼠李糖连接的二糖类化合物,抑制了香气的释放。地区间差异分析结果为不显着,不能作为区分菌株糖苷酶活性的依据。
通过对潜在的抑制参数 pH、温度和葡萄酒组分(乙醇、葡萄糖和果糖)对五种糖苷酶活性影响的研究,结果表明影响作用介于轻微促进和强烈抑制之间。五种糖苷酶在 pH 4.0 都有一个峰值,在葡萄酒的 pH 值范围内,只有较低的活性;糖苷酶最适温度都在 45℃左右;乙醇、葡萄糖和果糖在低浓度时有促进作用,高浓度时抑制作用显着,但各种酶活性表现为菌株依赖性。通过测定模拟酒条件下菌株的糖苷酶活性,有助于了解工业生产中酶的潜在活性。从本试验研究结果来看,SD-1f 在葡萄酒环境中糖苷酶活性。
总之,只有少数酒酒球菌对测定的底物表现出持续高活性,而葡萄酒的组成成分相当复杂,在实际生产中菌株酶活性受环境的综合影响更大, 所以在菌株筛选时需要慎重考虑菌株在葡萄酒环境中的生长状况和它对葡萄酒糖苷修饰方面的应用, 同时也突出了在后续工作中进行糖苷酶纯化接种发酵的重要性。(文章来源:食品科学杂志)
参考文献:
[1] BARTOWSKY E, HENSCHKE P, and PRETORIUS I. Chasing Wine Aroma---Does Oenococcus oeni have the potential to release aroma compounds from authentic grape precursors[J]. Wine Industry Journal, 2004, 19(2): 24-31.
[2] SWANGKEAW J, VICHITPHAN S, BUTZKE C E, et al. Characterization of β-glucosidases from Hanseniaspora sp. and Pichia anomala with potentially aroma-enhancing capabilities in juice and wine[J]. World Journal of Microbiology and Biotechnology, 2010, 27(2): 423-430.
[3] 李华。 葡萄酒工艺学[M]. 科学出版社,2007.
[4] GUEGUEN Y, CHEMARDIN P, JANBON G, et al. A very efficient β-glucosidase catalyst for the hydrolysis of flavor precursors of wines and fruit juices[J]. Journal of Agricultural and Food Chemistry, 1996, 44(8): 2336-2340.
[5] GUILLOUX-BENATIER M, SON H S, and BOUHIER M F. Activités enzymatiques: glycosidases et peptidases chez Leuconostoc oenos au cours de la croissance bactérienne. Influence des macromolécules des levures[J]. Vitis, 1993, 32:51-57.
[6] MESAS J M, RODRIGUEZ M C, and ALEGRE M. T. Basic characterization and partial purification of beta-glucosidase from cell-free extracts of Oenococcus oeni ST81[J]. Lett Appl Microbiol, 2012, 55(3): 247-55.
[7] GRIMALDI A, BARTOWSKY E, and JIRANEK V A survey of glycosidase activities of commercial wine strains of Oenococcus oeni[J]. Int J Food Microbiol, 2005, 105(2): 233-44.
[8] BOIDO E, LLORET A, MEDINA K, et al. Effect of beta-glycosidase activity of Oenococcus oeni on the glycosylated flavor precursors of Tannat wine during malolactic fermentation[J]. Journal of Agricultural and Food Chemistry, 2002, 50:2344-2349.
[9] UGLIANO M, GENOVESE A, and MOIO L. Hydrolysis of wine aroma precursors during malolactic fermentation with four commercial starter cultures of Oenococcus oeni[J]. Journal of Agricultural and Food Chemistry, 2003, 51(17): 5073-5078.
[10] DINCECCO N, BARTOWSKY E, KASSARA S, et al. Release of glycosidically bound flavour compounds of Chardonnay by Oenococcus oeni during malolactic fermentation[J]. Food Microbiology, 2004, 21(3): 257-265.
[11] MCMAHON H, ZOECKLEIN B W, FUGELSANG K, et al. Quantification of glycosidase activities in selected yeasts and lactic acid bacteria[J]. Journal of Industrial Microbiology & Biotechnology, 1999, 23: 198-203.
[12] GRIMALDI A, BARTOWSKY E, and JIRANEK V. Screening of Lactobacillus spp. and Pediococcus spp. for glycosidase activities that are important in oenology[J]. J Appl Microbiol, 2005, 99(5): 1061-9.
[13] PEREZ-MARTIN F, SESENA S, IZQUIERDO P M, et al. Screening for glycosidase activities of lactic acid bacteria as a biotechnological tool in oenology[J]. World J Microbiol Biotechnol, 2012, 28(4): 1423-32.
[14] GAGNE S, LUCAS P M, PERELLO M C, et al. Variety and variability of glycosidase activities in an Oenococcus oeni strain collection tested with synthetic and natural substrates[J]. J Appl Microbiol, 2011, 110(1): 218-28.
[15] BARBAGALLO R N, SPAGNA G, PALMERI R, et al. Assessment of β-glucosidase activity in selected wild strains of Oenococcus oeni for malolactic fermentation[J]. Enzyme and Microbial Technology, 2004, 34(3-4): 292-296.
[16] HERNANDEZ-ORTE P, CERSOSIMO M, LOSCOS N, et al. Aroma development from non-floral grape precursors by wine lactic acid bacteria[J]. Food Research International, 2009, 42(7): 773-781.
[17] MATEO J J and JIMNEZ M. Monoterpenes in grape juice and wines[J]. Journal of Chromatography A, 2000, 881(1):557-567.
[18] CASTRO V L, P REZ-COELLO M S, and CABEZUDO M D. Effects of enzyme treatment and skin extraction on varietal volatiles in Spanish wines made from Chardonnay, Muscat, Airén, and Macabeo grapes[J]. Analytica Chimica Acta, 2002,458(1): 39-44.
[19] GUNATA Z Y, BITTEUR S, BRILLOUET J M, et al. Sequential enzymic hydrolysis of potentially aromatic glycosides from grape[J]. Carbohydrate Research, 1988, 184: 139-149.
[20] MICHLMAYR H, SCHUMANN C, DA SILVA N M, et al. Isolation and basic characterization of a beta-glucosidase from a strain of Lactobacillus brevis isolated from a malolactic starter culture[J]. J Appl Microbiol, 2010, 108(2): 550-9.
[21] VOIRIN S G, BAUMES R L, SAPIS J C, et al. Analytical methods for monoterpene glycosides in grape and wine: II.Qualitative and quantitative determination of monoterpene glycosides in grape[J]. Journal of Chromatography A, 1992,595(1): 269-281.
[22] GRIMALDI A, MCLEAN H, and JIRANEK V. Identification and partial characterization of glycosidic activities of commercial strains of the lactic acid bacterium, Oenococcus oeni[J]. American Society for Enology and Viticulture, 2000,51(4): 362-369.
[23] MICHLMAYR H, EDER R, KULBE K D, et al. β-glycosidase activities of Oenococcus oeni: Current state of research andfuture challenges[J]. Mitteilungen Klosterneuburg, 2012, 62: 87-96.
[24] WILLIAMS P J, SEFTON M A, and MARINOS V A. Hydrolytic flavor release from non-volatile precursors in fruits, winesand some other plant-derived foods[J]. Recent developments in flavor and fragrance chemistry, 1993: 283-290.

2024/7/4至2024/7/6

2024/7/6至2024/7/8

2024/8/2至2024/8/4

2024/8/3至2024/8/5

2024/8/7至2024/8/9